2017-2018英语周报八年级外研第31期答案解析

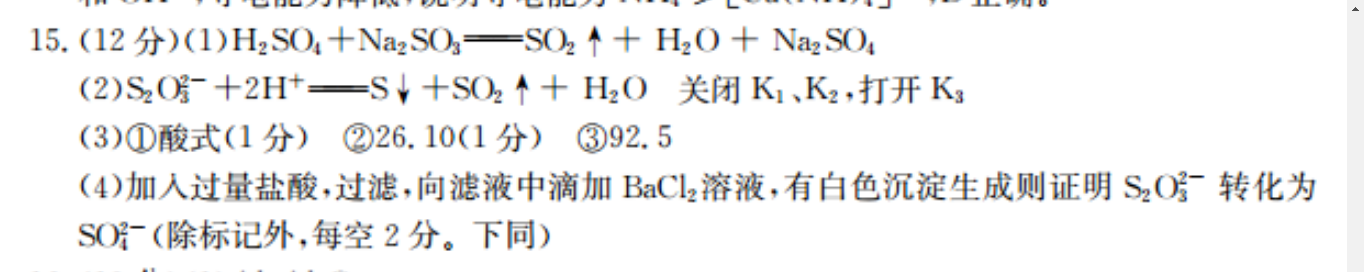
15.(12分)(1)H2SO4+Na2SO=SO2↑+H2O+Na2SO4(2)S2O-+2H+=S↓+SO2↑+H2O关闭K1、K2,打开K3(3)①酸式(1分)②26.10(1分)③92.5(4)加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成则证明S2O转化为SO-(除标记外,每空2分。下同)


28.(15分)(1)Co(1分)(g)+MEA(aq)=MEA℃C104(2分)(2分③12(2分)④Cu2+2HO==Cu(OHD)2+2H(2分)C2水解使溶液c(H)增大,H+HCO3(或CO2+MEA== MEATCOO)向逆反应方向移动,促进CO2解吸(2分)CO2+120=e③C与MEA发生反应,使溶液温度升高(或C2与MEA发生反应,使EMA浓度降低),促进CO2解吸。但在80C时,系统中CO2快速逸散,溶液中CO2浓度较低,反应的逆反应速率本身就较慢(2分解析202-(2分)(1)由表中数据信息可知,活化能应该是二氧化碳吸附状态的能量与中间状态物吸附状态的能量之差,由此可知,活化能较低的催化剂是C(2)①根据盖斯定律,将反应I、Ⅱ、Ⅲ相加,可以得到MEA和CO2反应的热化学方程式为:CO(g)+MEAa)== MEATCOO(a)△H=-104kJ/mola②反应Ⅲ的平衡常数只与反应物和生成物有关,与反应途径无关,所以MEA和CO2反应的平衡常数应为三个分步反应的平衡常数K之积,由它们的对数值可先计算出各分步反应的平衡常数K,再将三个分步反应的平衡常数相乘即可计算出总反应的平衡常数为104③由图中信息可知,前4min时的平均速率为4.8mmol4min=12 mmol/min④加入Cu2+在溶液中会发生水解,水解后溶液呈酸性,其离子方程式是C2++2H0=Cu(OH2+2H,因为Cu2水解使溶液c()增大,平衡CO2+H2O=BCO3(或CO2+MEA==MEAC0o+H)向逆反应方向移动,促进Co2解+⑤由题给信息可知Cu2+与MEA发生反应会放出大量的热,溶液温度升高(或Cu2与MEA发生反应,使EMA浓度降低),平衡将向促进Co2解吸方向移动。但在高温下系统中CO2快速逸散,溶液中CO2浓度已经较低了,解吸反应的逆反应速率本身就较,所以在40℃时,影响较大,但在80C时影响变小了(3)由图中信息可知,阴极发生CO2还原成CO的反应,2CO2+4e=2C0+202

以上就是2017-2018英语周报八年级外研第31期答案解析,更多英语周报答案请关注本网站。






