2022 英语周报 高一 牛津 39答案

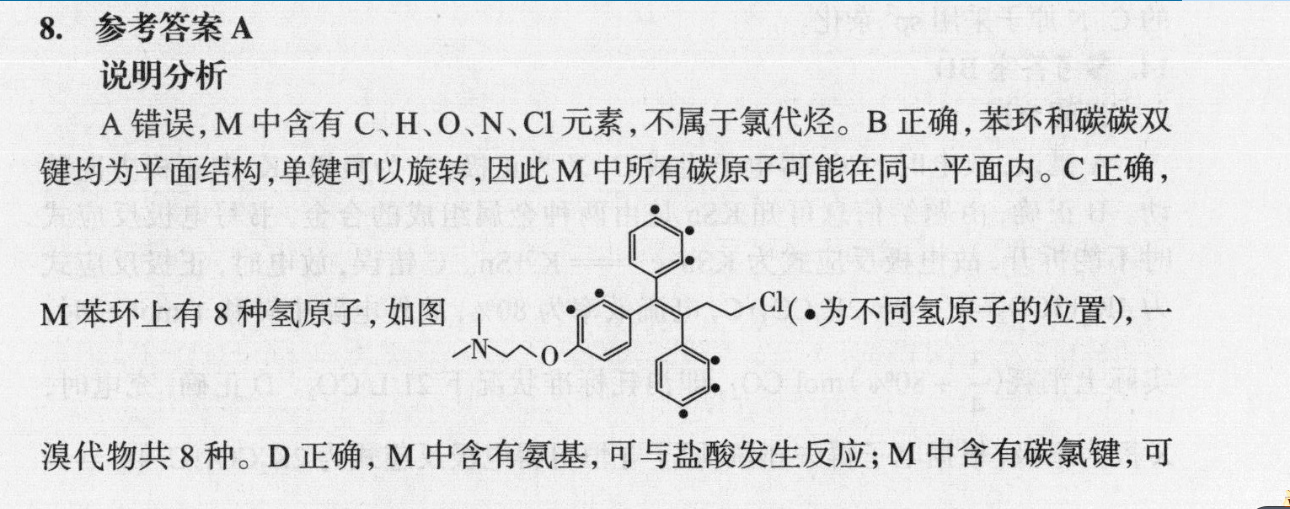

8.参考答案A说明分析A错误,M中含有C、H、O、N、C1元素,不属于氯代烃。B正确,苯环和碳碳双键均为平面结构,单键可以旋转,因此M中所有碳原子可能在同一平面内。C正确,M苯环上有8种氢原子,如图Cl(·为不同氢原子的位置,一O溴代物共8种。D正确,M中含有氨基,可与盐酸发生反应;M中含有碳氯键,可以与NaOH水溶液发生水解反应。


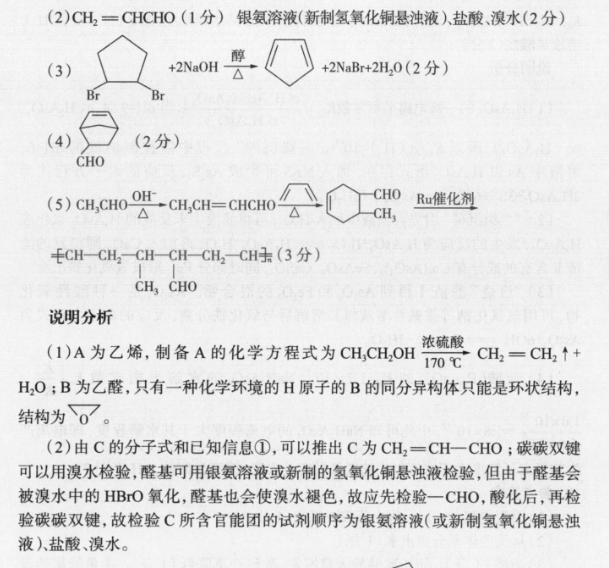
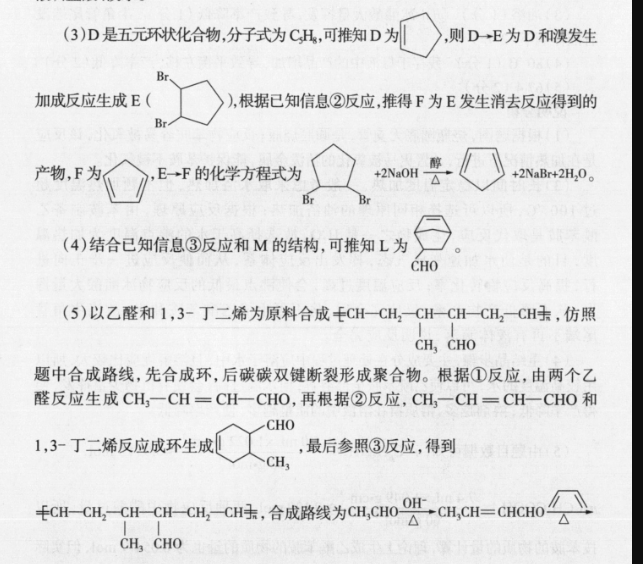
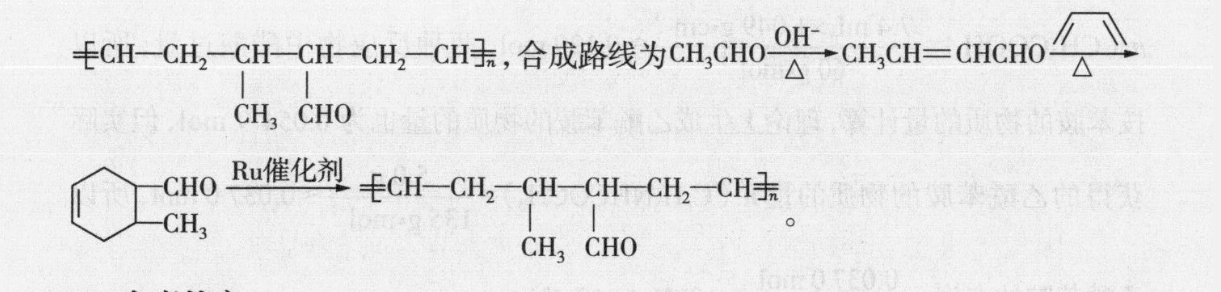
20.参考答案(1)AD(2分)(2)①-314(1分)②0.5或12(1分)③>(1分)由k正=1.9k可以得出K=1.9<2,说明平衡逆向移动,该反应为放热反应,可知T2>T1,逆反应气体分子数增多,依据pnRT,V一定,n和T均变大,故p变大(2分)(3) NECO3+HO=NH3·HO+HCO3(1分)1.26×103(2分)(4)3C0,18e+18H= CH, CH(OH)CH, +5H,O(23)说明分析(1)图中显示的能量转化形式有太阳能转化为化学能,热能转化为化学能化学能转化为热能(或电能),热能(或化学能)转化为动能,故A项错误。“单位时间内反应物的转化率”是描述化学反应速率,故B项正确。利用太阳能开发甲醇等液态燃料,既有利于“碳中和”,又有利于替代化石能源,减少污染,故C项正确。目前,工业获取H2更多采用水煤气法、烃裂解(或烃转化)法,故D项错误。(2)①由图可得 HCOOH(g)=CO(g)+H1O(g)△H=+72.6kJ·mola,Co(g)+02(g)=CO2(g) AH=-2830 kJ.mol b, H2(g)+02(g)H2O(g)△H241.8k·mo'c,由盖斯定律可得△H△H△H△H=31.4kJ·mol。②反应达到平衡时,v正=va,即k正·c(CO2)·c(H2)=k·c( HCOOH),K=2,可得k正=2k,则k=0.k正。③温度为T2℃时,k正=1.9k,则K=1.9<2,说明平衡逆向移动,该反应正向放热,故可得出T2>T,逆反应气体分子数增多,依据p=nRT,可得T2℃时的平衡压强大于T1℃时的平衡压强。(3)常温下,碳酸的电离常数K1=44×10、K2=4.7×10",计算 NHHCO3水解反应的平衡常数时用到碳酸的电离常数K1=44×107和NH3·HO的电离常数K=1.8×103。根据反应NH+HCO+H2O=NH2·HO+H2CO3可知,KKKakb=1.26×103。(4)由图可知,A极为正极,在A极上CO2得电子,发生还原反应,生成CH,CH(OH)CH3(2)CH2= CHCHO(1分)银氨溶液(新制氢氧化铜悬浊液)盐酸、溴水(2分)(3)+2NaOH+2NBr+2H2O(2分)(4)(2分)CHO(5) CH3CHO-A→CHCH= CHCHO△C0Ru催化剂CHCH2 - CH-CH-CH2CH(3分)CH CHO说明分析(1)A为乙烯,制备A的化学方程式为 CH, CH,OH硫胞CH2=CH2↑+70℃H2O;B为乙醛,只有一种化学环境的H原子的B的同分异构体只能是环状结构结构为(2)由C的分子式和已知信息①,可以推出C为CH2=CH-CHO;碳碳双键可以用溴水检验,醛基可用银氨溶液或新制的氢氧化铜悬浊液检验,但由于醛基会被溴水中的HBO氧化,醛基也会使溴水褪色,故应先检验一CHO,酸化后,再检验碳碳双键,故检验C所含官能团的试剂顺序为银氨溶液(或新制氢氧化铜悬浊液)盐酸、溴水。(3)D是五元环状化合物分子式为CH,可推知D,则D→E为D和溴发生加成反应生成E(),根据已知信息②反应推得F为E发生消去反应得到的产物,F为E→F的化学方程式为m+2NaBr+2H20。(4)结合已知信息③反应和M的结构,可推知L为CHO(5)以乙醛和1,3-丁二烯为原料合成CH-CH2 - CH-CH-CH2CH,仿照CH CHO题中合成路线,先合成环,后碳碳双键断裂形成聚合物。根据①反应,由两个乙醛反应生成CHCH=CH-CHO,再根据②反应,CH2CH=CH-CHO和CHO1,3-丁二烯反应成环生成最后参照③反应,得到+HcH- -CH--CH-ch-CH,合成路线为am,a=cmoCHCH2 -cH-CH--CH2CH,合成路线为 CH3CHO OH,CHCH= CHCHO△△CH CHOCHo ug催化剂ECH-CH2-CH-CH--CH-CH+CH CHO

以上就是2022 英语周报 高一 牛津 39答案,更多英语周报答案请关注本网站。






