2022英语周报第16期外研版答案



17.参考答案(1)p(1分)3(1分)(2)①sp3(1分)4(1分)②黑磷具有层状结构,层与层之间的键合比层内的键合弱,与石墨相似,故具有导电性(2分)(3)>(1分)P>As>Ga(2分(4)①6(1分)②238×109(2分)说明分析(1)N原子核外有7个电子,电子排布式为1s2s2p2,按电子排布N元素在周期表分区中属于p区元素,基态N原子的未成对电子数目为3个。(2)①根据P4的分子结构,P4分子为正四面体结构,P4分子中P原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,则白磷分子中磷原子的杂化轨道类型为sp3,每个白磷分子中含有孤电子对数目为4。②黑磷和石墨具有相似性,也是层状结构,联想石墨晶体的结构,则黑磷能够导电的原因是黑磷具有层状结构,层与层之间的键合比层内的键合弱,与石墨相似,故具有导电性(3)同一周期从上到下,元素非金属性逐渐减弱,最高价氧化物对应的水化物酸性逐渐减弱,所以H3PO4的酸性大于H3AsO4的酸性;同主族元素从上到下电负性逐渐减小,同周期主族元素从左至右,电负性逐渐增大,P和As同主族,电负性P>As,Ga和As同周期,电负性Ga

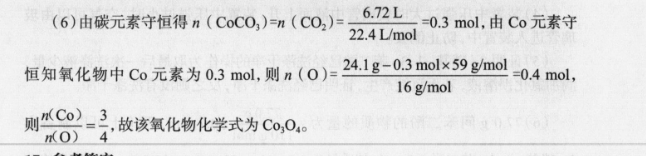
16.参考答案(1) NaAlO2(1分)分液漏斗、烧杯(2分)(2)作还原剂(或将钴元素还原为二价钻)(1分)4Co3O4+Na2S2O3+11H2SO412CoSO+Na, SO4 +1lH,0(2 5)(3)53~6(或5.5左右)(1分)(4)A(1分)(5)NaCO3的滴速过快或浓度太大,会使溶液碱性增强而产生Co(OH2(2分)(6)Co3O4(2分)说明分析(1)滤液①主要成分为 NaAlO2;操作②为分液,所用到的玻璃仪器主要为分液漏斗、烧杯。(2)H2O2的作用为还原剂;若用Na2S2O3代替H2O2,根据题意知,生成CoSO和Na2SO4,结合得失电子守恒、元素守恒配平得方程式为4Co3O4+Na2S2O3+11H1SO-12Coso4+Na SO4+llH,O.(3)萃取时,要确保Co萃取率高,但L萃取率要低,结合图像知,最佳pH为53~6(或55左右)(4)反萃取即使萃取平衡逆向移动,根据平衡移动原理,在不引入新杂质的情况下可加入H2SO4,使平衡逆向移动,从而达到反萃取的目的。(5Na2CO3的滴速过快或浓度太大,会使溶液碱性增强而产生Co(OH2杂质。(6)由碳元素守恒得n(CoCO3)=n(CO2)=672L=03mol,由Co元素守22, 4L/mol恒知氧化物中Co元素为03mo,则n(O)=241g-03mol×59g/mol16 g/molKO~3,.故该氧化物化学式为CoO

以上就是2022英语周报第16期外研版答案,更多英语周报答案请关注本网站。






