2022英语周报高二课标第41期答案

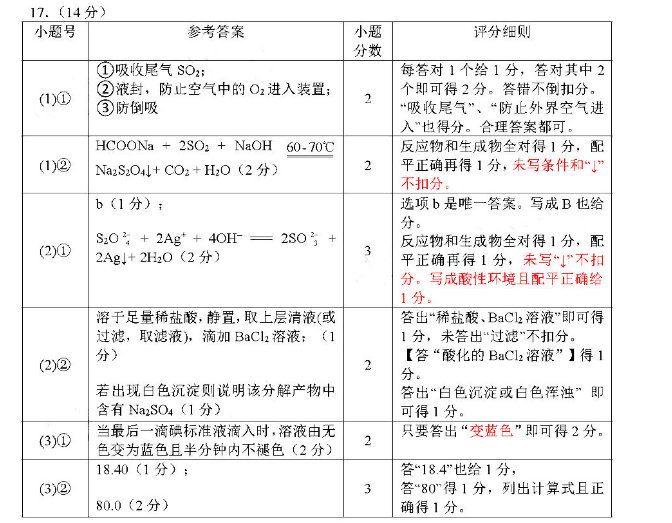
小题号参考答案小题评分细贝分数①吸收尾气SO2每答对1个给1分,答对其中2(1)①2)液封,防止空气中的O2进入装置个即可得2分。答错不倒扣分③防倒吸收尾气”、“防止外界空气进入”乜得分。合理答案都可反应物和生成物全对得1分,配()2NaO4+CO2+HO(2分)2平正确再得1分,未写条件和不扣分b(1分选项b是唯一答案。写成B也给Ag+ 40H反应物和生成物全对得1分,配2Ag』+2H2O(2分平正确再得1分,未写“↓”不打分。写成酸性环境且配平正确给溶于足量稀盐酸,静置,取上层清液或答出“稀盐酸、BaCl2溶液”即可得过滤,取滤液,滴加BaCl2溶液;(11分,未答出“过滤不扣分2【答“酸化的BaC2溶液”】得1若出现白色沉淀则说明该分解产物中答出“白色沉淀或白色浑浊”即含有Na2SO4(1分)可得1分(0学后高标液演入时液由无2只要答出“变色”即可得2分1840(1分)答“184”也给1分3)280”得1分,列出计算式且正80.0(2分



35.(15分)(1)sp3杂化(1分)头碰头(1分)0(1分)(2)N>O>C(2分)O-H(1分)出++2分)甘氨酸铁为分子品体,氧化铁为离子晶体(2分)(4)①(1分)②6.2(565×10)(2分)14)×4565(2分)解析:(1)甘氨酸分子中H一N键是N原子通过sp3杂化轨道与氢原子的s轨道通过头碰头的方式形成o键。(2)NH2CH2COOH分子所含的元素中,属于同一周期的元素为C、N、O,一般面言同一周期元素随着原子序数递增第一电离能增大,由于N的2p轨道半充满,所以第一电离能大于氧,故三种元素的第一电离能;N>O>C;由于甘氨酸分子中电负性最小的是H,最大的是O,所以键的极性最强的键是O-H键。(3)亚铁离子的电子排布为1s2s2p53s23p53d,所以最外层电子排布图为根据熔点可知甘氨酸亚铁为分子晶体,微粒之间的作用力是分子间作用力,氟化亚铁为离子晶体,微粒之间的作用力是离子键,故氟化亚铁的熔点较高(4)根据图1可知N和Ga原子的配位数均为4②根据图1可知晶胞质量为:02g,根据图2可知晶胞体积为:(565×10-m)cm2所以晶胞密度为.02×10×(565×10-m)g=m2,a位置的Gn与b位置的N的距离为体对角线的四分之一,因为体对角线为3×565,所以a位置的Ga与b位置的N的距离为565/3pmo

以上就是2022英语周报高二课标第41期答案,更多英语周报答案请关注本网站。






